10
Un paseo con vistas
Los creacionistas adoran los ojos. No sólo porque sean obra de Dios, ni tampoco —cabe suponer— por lo mucho que les ayudan a comprender el mundo. La razón real es una famosa frase de Darwin, redactada en un momento de aparente bajón e incluida en el capítulo de El origen de las especies dedicado a las dificultades de la teoría:
Suponer que el ojo, con todos sus inimitables dispositivos para ajustar el foco a diferentes distancias, para admitir diferentes cantidades de luz, y para la corrección de las aberraciones esférica y cromática, pueda haberse formado por selección natural parece —lo confieso espontáneamente— absurdo en el mayor grado posible.
¿Qué más puede desear un creacionista? Richard Dawkins, que opina que el autor del Origen «cedió demasiado cuando se echó atrás para admitir la dificultad de la evolución del ojo», se ha quejado con razón de que los creacionistas siempre interrumpen la cita en ese punto, así que me apresuro a añadir la frase que Darwin escribió tres líneas más abajo:
[Pero] la razón me dice que si se puede demostrar que existen muchas gradaciones, desde un ojo sencillo e imperfecto a un ojo completo y perfecto, siendo cada grado útil al animal que lo posea, como ocurre ciertamente; si además el ojo alguna vez varía y las variaciones son heredadas, como ocurre también ciertamente; y si estas variaciones son útiles a un animal en condiciones de vida cambiantes, entonces la dificultad de creer que un ojo perfecto y complejo pudo formarse por selección natural, aun cuando insuperable para nuestra imaginación, apenas puede considerarse real.
El asombro de Darwin se hubiera multiplicado hoy por cincuenta, que es el número aproximado de veces que, según calculan los zoólogos contemporáneos, han evolucionado los ojos de manera independiente en unos u otros linajes de animales bilaterales. Pero es mejor ver la cuestión desde el ángulo opuesto y afirmar que la depresión de Darwin se hubiera aliviado en el mismo factor cincuenta, ya que, si un proceso complejo ha ocurrido con semejante profusión a lo largo de la historia, cabe concluir que los mecanismos evolutivos deben ser capaces de promoverlo con notable facilidad. Lo cierto es que los ojos —las cincuenta evoluciones del ojo— conforman hoy uno de los argumentos más convincentes que la ortodoxia darwinista puede aducir sobre el poder de la selección natural para convertir gradualmente lo simple en complejo.
Una de las objeciones antidarwinistas más clásicas es el llamado problema de la preadaptación. Aduce que una estructura compleja no ha podido evolucionar paso a paso por selección natural, puesto que la décima parte de esa estructura no sirve para nada, y por lo tanto nunca hubiera llegado a prosperar. Si el primer paso (la preadaptación) no se impone en la población, el segundo paso nunca puede llegar a ocurrir. El problema de la preadaptación es un argumento interesante y muy discutido por los evolucionistas teóricos, pero naufraga irremisiblemente en el caso del ojo: la décima o incluso la centésima parte de un ojo sí sirve para algo, y se pueden reconstruir y documentar rutas graduales más que admisibles para la generación histórica de estos asombrosos dispositivos biológicos.
La mera sensibilidad a la luz es un problema bioquímico fácilmente abordable, debido a que numerosas moléculas orgánicas muy comunes pueden excitarse energéticamente al recibir un fotón. La antiquísima fotosíntesis se basa en último término en esa clase de moléculas. Los tipos más primarios de respuesta a la luz —acercarse o alejarse de ella, principalmente— eran ya usados con liberalidad por las bacterias, los protistas (eucariotas unicelulares) y algunos organismos diploblásticos mucho antes de que Urbilateria entrara en escena en las postrimerías del precámbrico. Los zoólogos evolutivos suelen partir de esos modestos orígenes para elaborar modelos graduales ascendentes en los distintos linajes de animales bilaterales que han desarrollado ojos, a veces extraordinariamente complejos: tras los primeros ajustes bioquímicos, las moléculas fotosensibles, o pigmentos, se van agrupando con el paso del tiempo en capas apiladas hasta formar un tipo de célula llamada fotorreceptor, especializada en captar luz con eficiencia, que de un modo u otro puede acabar asociándose con un nervio. Los fotorreceptores aumentan gradualmente en número hasta formar una capa celular, que más adelante en el linaje del animal se curva para poder discriminar de qué dirección proviene la luz. Generaciones más adelante, cualquier masa transparente y más o menos redondeada hace las funciones de una lente rudimentaria (precursora del cristalino) que después se va perfeccionando a lo largo de miles de generaciones. Entonces pueden empezar a evolucionar mecanismos progresivamente más refinados para enfocar el cristalino, regular el paso de luz (pupila), mover el ojo, etcétera. En Escalando el monte improbable, Richard Dawkins desarrolla inmejorablemente estos argumentos.
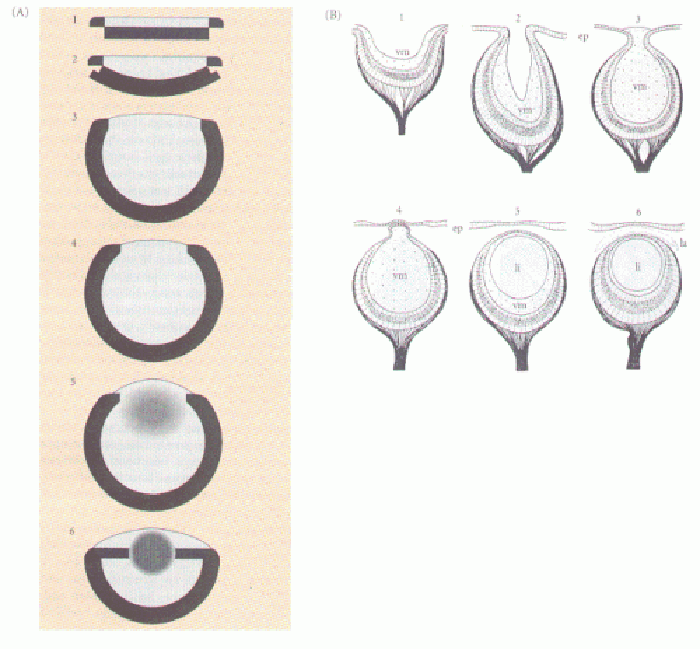
FIGURA 10.1: Evolución gradual del ojo.
La lista de tareas a la que se enfrenta la selección natural para construir un ojo es larga y tediosa, pero puede descomponerse sin mucha dificultad en subrutinas graduales, y cada paso hipotético se ha documentado bien en los animales actuales, que despliegan convincentes gamas de complejidad creciente (puedan o no ordenarse en un solo linaje). Lo más importante, como hemos dicho más arriba, es que cualquier modesto inicio de cada subrutina, o cualquier pequeña mejora en ella, supone una ventaja obvia para su portador. Ver un poco siempre es mejor que no ver nada, y después nunca estorba un poco más de nitidez. La evolución de los ojos es por esa razón un caso de estudio óptimo para mostrar a la selección natural en acción.
Un aspecto importante revelado por la zoología comparada es que no hay una forma única de resolver cada problema de la visión, y los distintos animales bilaterales hemos utilizado una u otra estrategia evolutiva para abordarlos. Por ejemplo, los peces, los anfibios y algunos reptiles cambian el foco desplazando el cristalino atrás y adelante, mientras que los demás reptiles, las aves y los mamíferos lo hacemos deformando el cristalino para volverlo más plano o más redondeado. Las dos soluciones funcionan muy bien, pero los músculos implicados han debido seguir rutas evolutivas muy diferentes. Otro ejemplo: en algunos gusanos, el cristalino ha evolucionado a partir de una masa vítrea cuya función original era proteger a la retina, mientras que en otros grupos lo ha hecho mediante un engrosamiento de la córnea.
Todas esas variaciones, con ser notables, palidecen junto a la extravagante invención de los insectos y los crustáceos: el ojo compuesto. Mientras la mayoría de los linajes animales nos dedicábamos a perfeccionar un ojo con una sola lente y una sola retina, los ancestros de los insectos optaban por un dispositivo compuesto por cientos o miles de ojos (omatidios) relativamente independientes, cada uno con su propia lente y su propio juego de fotorreceptores. Cada omatidio capta una pequeña parte del mundo que rodea al insecto, y el cerebro de éste ensambla luego esa información para generar una imagen pixelada, no muy distinta de la cara de un policía emitida en un telediario. La mayoría del mundo bilateral ha resuelto los retos de la visión a fuerza de jugar con la óptica, una disciplina simple y eficaz, pero los insectos han preferido introducirse en el pantanoso terreno de la computación digital, con estrategias evolutivas retorcidas, resultados desiguales y una resolución de imagen cuando menos discutible. Aún así, el ojo compuesto ha evolucionado, independientemente del de los insectos, en algunos moluscos bivalvos (primos del mejillón). En fin, allá ellos.
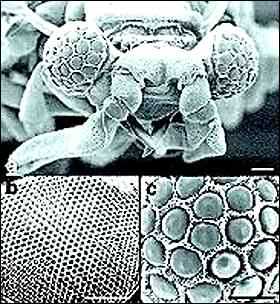
FIGURA 10.2: El ojo compuesto es una extravagante invención evolutiva de los artrópodos.
Hemos visto que la ortodoxia darwinista sufre con los sucesos bruscos, discretos, sin intermediarios y que sólo han ocurrido una vez en la historia, como el origen de la célula eucariota y la aparición de Urbilateria. Los ojos representan el caso exactamente contrario: han evolucionado muchas veces de forma independiente, con soluciones muy distintas, y el proceso ha dejado cada vez numerosos testimonios actuales de su carácter gradual y de sus frecuentes y progresivas ramificaciones en el espeso árbol de la vida animal. Eso es lo que uno espera del mecanismo darwiniano de la selección natural: que explore con profusión y parsimonia muchas ramas divergentes, que revele una facilidad natural para crear rutas graduales alternativas, que sea capaz de enfrentarse a cada problema particular planteado por el entorno y la competencia con una historia convincente de mejoras acumulativas. Pese a las tribulaciones de Darwin, la evolución plural de los ojos ha escrito una bella y sólida historia darwinista.
Y, sin embargo, la genética —otra vez— ha venido a sumergir esta arcadia ortodoxa en las brumas de una nueva paradoja. Algunas personas padecen una enfermedad genética, llamada Aniridia, que afecta al desarrollo del ojo. La Aniridia es muy similar a una enfermedad genética del ratón llamada smalleye (ojo pequeño). Y en la mosca se conoce desde hace tiempo una mutación denominada eyeless (sin ojos), que reduce el tamaño del ojo en las versiones más débiles y lo elimina por completo en las más fuertes. Hasta ahí nada raro. Aunque hayan evolucionado independientemente, los ojos de cualquier animal deben formarse, por supuesto, dirigidos por numerosos genes, y nada tiene de particular que cualquier especie sufra mutaciones en cualquiera de ellos que afectan al desarrollo de ojo. Las moscas y los humanos, como cualquier otro animal, también sufren diversas mutaciones que reducen el tamaño de su cuerpo, y nadie se sorprende por ello. Pero el grupo de Walter Gehring, de la Universidad de Basilea en Suiza, demostró en 1994 que las enfermedades genéticas Aniridia (humanos), smalleye (ratones) y eyeless (moscas) se deben a mutaciones en el mismo gen. Llamaremos a ese gen eyeless, como los genetistas de Drosophila, aunque los especialistas en otras especies prefieren denominarlo Pax-6.

FIGURA 10.3: Cuando la genética mete el hocico, hasta subir un simple piso puede plantear paradojas.
El gen eyeless es esencial para el desarrollo del ojo en todos los animales en los que este problema se ha podido examinar. Como de costumbre, y puesto que eyeless existe y cumple la misma función en artrópodos como la mosca y en vertebrados como nosotros, no hay más remedio que inferir que ya existía, y cumplía la misma función, en el precursor evolutivo de ambos, Urbilateria. En Drosophila. los genetistas pueden provocar que el gen eyeless se active en lugares incorrectos y, cuando hacen esto, la mosca desarrolla un ojo completo (y hasta funcional, al menos en parte) allí donde el gen se ha activado artificialmente, sea en las alas, las patas o las antenas. Esto es muy importante.
Que el fallo en un gen estropee el ojo sólo quiere decir que ése es uno de los muchos genes que intervienen en el desarrollo del ojo. Pero si la activación incorrecta del mismo gen genera un ojo en un lugar extraño, lo más probable es que ese gen sea el regulador esencial del proceso; un gen que regula a decenas, si no a centenares, de otros genes necesarios para la formación del ojo. Y efectivamente así es. La proteína fabricada por el gen eyeless (la proteína eyeless) tiene la propiedad de pegarse a muchos otros genes implicados en el desarrollo del ojo, y de activarlos en consecuencia: son los genes downstream del gen eyeless, que en esto se comporta de modo similar a los genes de la fila Hox. De hecho, eyeless tiene una homeohox, al igual que los genes Hox, y ya sabemos que esa secuencia de 180 letras en el ADN codifica (se traduce en la proteína como) un segmento de aminoácidos con la propiedad de pegarse a baterías completas de genes downstream para activarlos o reprimirlos.
Otro descubrimiento importante es que el gen eyeless de los ratones o de los humanos es también capaz, cuando se añade artificialmente al cuerpo de la mosca, de generar ojos allí donde se le ha forzado a activarse: no ojos humanos, desde luego, sino ojos de mosca. Como ya vimos en el caso de la fila Hox, esto indica que no sólo la función del gen eyeless se ha mantenido intacta desde su primera utilización en Urbilaleria, hace 600 millones de años, sino que también la red de genes downstream se ha conservado en gran medida intacta en todos los animales. De otro modo, el gen humano no lograría hacer un ojo en la mosca.

FIGURA 10.4: La activación del gen eyeless en lugares erróneos causa la aparición de un ojo completo (en la antena, en este caso), y parcialmente funcional.
La sorpresa mayúscula acabó de redondearse en septiembre de 2000, cuando Carl Neumann y la gran genetista y premio Nobel Christiane Nüsslein Volhardt, del Instituto de Biología del Desarrollo Max Planck en Tubingen (Alemania), elucidaron en un vertebrado (el pez cebra) los fascinantes detalles del proceso. Los pasos esenciales de la formación del ojo se conocían ya muy bien en la mosca. La estrategia disparada por el gen eyeless empieza por inducir la conversión de una fila de células de la piel en neuronas de la retina. En esas primeras neuronas se activa un gen llamado hedgehog, cuya proteína sale de la neurona y envía una señal a las células de la piel vecinas, a ambos lados de las neuronas originales. Esa señal provoca que estas células de la piel se conviertan también en neuronas de la retina, y que luego activen el gen hedgehog, y vuelta a empezar. El resultado es una auténtica onda que se propaga desde una línea central hacia los lados, y que a su paso va convirtiendo las células de la piel en neuronas hasta que se ha formado una retina esencialmente completa y conectada a los nervios que transmitirán las señales luminosas al cerebro de la mosca. Pues bien, el proceso de formación del ojo en los vertebrados, como el ser humano, es exactamente el mismo. El gen eyeless induce la formación de una hilera inicial de neuronas de la retina que activan el gen hedgehog, que envía una señal a las células de la piel vecinas para que se conviertan a su vez en neuronas de la retina que activan el gen hedgehog y así sucesivamente, con el mismo resultado que en la mosca: una onda que se propaga desde una línea central hacia los lados hasta formar una retina completa y conectada a los nervios que luego transmitirán la señal luminosa hasta el cerebro. Ésta es la esencia de la construcción de un ojo —de cualquier ojo—, y es evidente que no ha evolucionado independientemente en los insectos y en los vertebrados, sino que debe existir desde el mismísimo Urbilateria. Es muy importante darse cuenta de que las similitudes entre todos los animales bilaterales actuales no se limitan a uno o dos genes sueltos, más o menos implicados en la construcción del ojo. Tanto eyeless como hedgehog necesitan una batería completa de otros genes para poder funcionar (transmitir una señal de una célula a la vecina se dice pronto, pero implica a varias decenas de genes intermediarios que trabajan de forma coherente y coordinada), y toda esa batería genética está también implicada en la formación del ojo de cualquier animal bilateral, y ya lo debía estar en Urbilateria.

FIGURA 10.5: La activación generalizada de eyeless ha convertido a esta pobre mosca en un auténtico saco de ojos. Ver para creer.
¿Qué quiere decir todo esto? El problema recuerda mucho al que ya hemos visto en el caso de la organización del eje anteroposterior de los animales. Las distintas estructuras desplegadas a lo largo de ese eje —picos, alas y garras en las aves: dientes, manos y pies en los mamíferos— han evolucionado por separado en cada linaje animal, pero el fundamento lógico del sistema es el mismo en todos ellos: la fila Hox inventada por Urbilateria. En el caso que nos ocupa, los ojos han evolucionado en cada linaje animal de forma independiente, pero el fundamento lógico de la construcción del ojo, un fundamento nada simple, por cierto, es el mismo en todos los animales bilaterales. Volvemos a encontrarnos con Urbilateria, aunque en relación con un sistema biológico muy distinto de la organización de estructuras en un eje.
Es muy importante reparar en que los detalles de la construcción del ojo no se originaron en Urbilateria. Los zoólogos evolutivos, como hemos visto, han mostrado convincentemente que elementos estructurales como los cristalinos y sus sistemas de enfoque han evolucionado de forma independiente en distintos linajes de vertebrados, por ejemplo. Y no hablemos ya de las numerosas peculiaridades estructurales del ojo compuesto de los insectos. Todo parece indicar que los cristalinos, los omatidios y otros dispositivos oculares son invenciones evolutivas muy posteriores a Urbilateria, y que se han desarrollado varias veces de forma gradual e independiente. Y, sin embargo, en otro sentido deben considerarse meras versiones de un diseño básico de Urbilateria, un diseño complejo, pero tan útil y versátil que ha permanecido incuestionado e invariante durante los 600 millones de años que han transcurrido desde su invención única e irrepetible. Éste es el tipo de fenómeno evolutivo con el que el darwinismo se siente profundamente incómodo. El eje anteroposterior y el ojo son dos ejemplos de sistemas complejos y fundamentales de diseño surgidos una sola vez en la historia, con un buen acabado desde su primera aparición pública, y que se han revelado después extraordinariamente resistentes a los meticulosos oficios de la selección natural (que, sin embargo, sí parece capaz de elaborar refinamientos sobre ese esquema básico).
En este sentido abstracto, el eje anteroposterior y los ojos son parecidos a la célula eucariota, el caso más clamoroso de evolución no darwiniana demostrado hasta la fecha. Y no son los únicos, ni mucho menos. He empezado este capítulo por los ojos porque esos órganos son una especie de McGuffin del pensamiento evolutivo desde tiempos de Darwin, pero hay otros casos igualmente chocantes. El siguiente párrafo es de un recorte de prensa publicado en 1998:
Los profesores de biología llevan más de un siglo enseñándonos a desconfiar de las apariencias. Las alas de pájaros y murciélagos son parecidas y sirven para lo mismo, pero no tienen un origen común: son dos inventos evolutivos independientes. Lo mismo cabe afirmar de la forma ahusada de peces y ballenas. Y también cabía afirmarlo de las patas de insectos y mamíferos… hasta hace dos semanas, cuando un equipo de investigación español reveló que las patas de estos animales tan dispares comparten una misma lógica genética. Y la comparten con tanto detalle que sólo un origen común puede explicarlo. Las apariencias, ya se ve, no siempre engañan. (El País, 22 de julio de 1998.)
El artículo era una reseña de un trabajo publicado en Nature por los laboratorios de Ginés Morata, Miguel Torres y Carlos Martínez, que demostraba por encima de toda duda razonable que las patas (y otros apéndices) de todos los animales bilaterales se construyen siguiendo un complejo sistema de diseño que ya existía en Urbilateria, y que todos los animales bilaterales han utilizado sin excepción, y sin que la selección natural haya conseguido alterarlo en lo fundamental, durante los 600 millones de años que han transcurrido desde su aparición. Que la pata de una mosca y la pierna humana sean estructuras homólogas, es decir, que compartan el mismo origen evolutivo, es el primer ejemplo de herejía que le vendría a la cabeza a cualquier zoólogo preguntado al respecto. Pocos especialistas en morfología lo admitirán aún hoy. Y sin embargo es así, al menos en cierto sentido profundo de la palabra homología.
Los apéndices (piernas, brazos, patas, alas, antenas) de cualquier animal bilateral inician su desarrollo embrionario de modo muy parecido. Una vez que el cuerpo central del embrión (llamémoslo tronco, sin mucha propiedad) está formado en sus líneas generales, pequeños grupos de células situados en la zona lateral del embrión perciben cuál es su posición aproximada en el tronco y cambian en consecuencia su programa genético. Cada grupo de células formará un apéndice. El nuevo programa genético lleva a esas células a proliferar ordenadamente a lo largo de un eje perpendicular al del cuerpo, y a activar los sistemas necesarios para organizar el apéndice durante su formación. Los genes clave para este proceso —los que comunican a las células dónde están, los que activan el nuevo programa de proliferación celular y los que establecen el nuevo eje del apéndice— son esencialmente los mismos en Drosophila y en el ratón (es decir, en todos los animales bilaterales) y guardan idénticas relaciones entre sí. Se trata otra vez de una red compleja e integrada de genes: una red que se ha mantenido invariante en la evolución a partir de su primera aparición en Urbilateria. Como en el caso del ojo, los distintos linajes animales han experimentado después procesos evolutivos, tal vez graduales, que han convertido sus apéndices en dispositivos biológicos con formas, apariencias y funciones muy distintas, pero todos se basan en el mismo sistema básico de diseño.
Dije antes que los apéndices de todos los animales bilaterales son homólogos, pero sólo en cierto sentido profundo. Una de las implicaciones académicas de la genética contemporánea es que el concepto de homología necesita una revisión sutil y perspicaz. Sabemos que las alas de los cuervos y las de los murciélagos no son estructuras homologas: el último antecesor común de las aves y los murciélagos era un reptil sin alas. Por lo tanto, la evolución de las alas ha ocurrido de modo independiente en esos dos linajes. En ambos casos, el par de patas delantero ha evolucionado hasta formar un par de extremidades útiles para el vuelo. Se trata de un caso de manual de lo que se conoce como evolución convergente: dos procesos evolutivos independientes generan órganos con formas y funciones similares. Sin embargo, si todos los apéndices de los animales bilaterales tienen un origen común, las alas de cuervos y murciélagos son homólogas en un sentido más profundo: un sentido en el que ambas sólo han evolucionado una vez, en tiempos de Urbilateria. ¿Son homólogas o no son homólogas? Todo lo que podemos decir es que no son homólogas en tanto alas, pero sí en tanto apéndices.
El ejemplo anterior puede parecer una trivialidad, pero es fácil predecir que la biología va a encontrar pronto muchas ambigüedades más confusas que ésa. Un ejemplo: hasta hace poco, los entomólogos (estudiosos de los insectos) no habían logrado decidir si los segmentos de la mosca eran verdaderamente homólogos a los de la langosta, debido a que el desarrollo embrionario de ambos insectos es radicalmente diferente. El embrión de la langosta, como vimos en el capítulo 8, va generando los segmentos uno a uno, al mismo tiempo que las células se van dividiendo y separando de la zona de proliferación. El embrión de la mosca, sin embargo, se segmenta prácticamente de golpe y sin que la proliferación celular tenga nada que ver. De pronto, a una célula le puede tocar pertenecer a la parte posterior del tercer segmento, y a la que hasta entonces era su amorosa vecina le toca pertenecer a la parte anterior del cuarto. Esta separación ocurre en los primeros momentos de la vida del embrión, pero sus efectos son indelebles: en cuestión de minutos, las dos células vecinas e idénticas se ven separadas por una frontera invisible que ni ellas ni sus hijas violarán nunca más durante todo el resto del desarrollo y la vida de la mosca.
Es difícil imaginar dos mecanismos de segmentación más dispares que los de las moscas y las langostas. Pero hoy, pese a todo lo anterior, muchos especialistas se inclinarían a pensar que los segmentos de los dos insectos son homólogos, y ello por una única razón: que comparten gran parte del sistema genético que organiza las células dentro de cada segmento. Se llama grupo de genes de polaridad segmental, y fue uno de los varios grupos de genes esenciales para el desarrollo animal que descubrió en 1980 la mencionada Christiane Nüsslein Volhardt. El argumento de la homología parece sensato. Pero Sean Carroll y su equipo descubrieron en 1999 que los mismos genes de polaridad segmental se encargan de dibujar los típicos círculos (ojos) que adornan las alas de las mariposas (Keys y colaboradores, 1999.) ¿Deberemos ahora concluir que los segmentos de las moscas son homólogos a los dibujos de las alas de las mariposas? Esto ya parece excesivo. Intentemos adoptar la misma solución salomónica que en el caso de las alas de cuervos y murciélagos: los segmentos de la mosca no son homólogos a los dibujos de las mariposas en tanto segmentos, pero sí lo son en tanto… ¿en tanto qué?
Solución: en tanto operaciones abstractas, los genes de polaridad segmental, pese a su nombre, no entienden nada de segmentos de mosca ni de pigmentos de mariposa: son diseñadores abstractos que generan formas puras o patrones geométricos. Una vez que ellos han dibujado el boceto, otros genes que sí son específicos de cada sistema les hacen el trabajo sucio y llenan la forma pura de estructuras segmentales o de pigmentos alares.
Las proteínas de polaridad segmental son muy variadas: algunas viven en el núcleo celular controlando a otros genes, otras se alojan en la membrana exterior de la célula, otras la traspasan y viajan hasta otras células vecinas. Si forman un sistema integrado no es porque sean parecidas, sino porque se entienden muy bien. La proteína viajera puede interactuar con las que están en la membrana, que a su vez pueden interactuar con las de dentro de la célula y decirle a la del núcleo que active a tal gen o reprima a tal otro. Juntas forman un sistema que les permite a las células saber dónde están; dónde están unas respecto de otras. Por eso, cuando cualquiera de estas proteínas resulta dañada, las células empiezan a hacer cosas que corresponden a otro lugar, y se orientan en direcciones incorrectas: pierden el norte (y la latitud). En el embrión de la mosca, los genes de polaridad segmental se activan en estrechas bandas transversales, y cada banda organiza un segmento del cuerpo. En el ala de la mariposa, se activan en puntos, y cada punto organiza un dibujo circular. Los detalles no se conocen del todo, pero esto es lo que pasa en esencia. Los segmentos de la mosca son homólogos a los dibujos de la mariposa en tanto se basan en la misma operación abstracta. Esto no quiere decir que un insecto primitivo tuviera un órgano del que provienen ambos (digamos, un segmento circular pigmentado). Pero sí quiere decir que hubo un insecto primitivo que ya disponía de la operación abstracta: el juego completo de genes de polaridad segmental que permiten a las células saber dónde están unas respecto de otras.
Equipados con este nuevo concepto sutil de homología, intentemos ahora reconstruir un retrato robot de Urbilateria. Sabemos, por ejemplo, que Urbilateria ya tenía genes de polaridad segmental (me callé antes, para no liar más las cosas, que este sistema es universal en todos los animales bilaterales). Es probable que ya los utilizara para organizar sus segmentos (sabemos que todos los animales bilaterales están metamerizados en mayor o menor medida), pero podemos descartar con confianza que los empleara también para dibujar círculos en sus alas, toda vez que no tenía alas (no son muy útiles en el fondo oceánico). Bien, ya se ve cuál será nuestra metodología para construir el retrato robot. Consiste en apurar las deducciones formales que nos permite hacer la genética comparada y sopesarlos con los límites que nos imponen el contexto y la sensatez. Sigamos.
¿Tenía ojos Urbilateria? ¿O sólo tenía una operación abstracta que lo mismo puede valer para hacer un ojo que un lóbulo hepático? Lo más probable es que tuviera ojos. El sistema eyeless/hedgehog en que se basa la formación del ojo se usa en los animales actuales para hacer ojos, y es lógico que así sea: se trata de una estrategia genética para crear células fotorreceptoras, especializadas en captar luz eficazmente, y asociarlas con las neuronas que deben recibir los impulsos de esas células. Es decir, para construir el fundamento de un ojo, a todos los efectos. Lo que no podemos saber es cómo eran los ojos de Urbilateria. Podían ser compuestos, como los de los insectos, o de lente y retina única, como los nuestros, pero es mejor suponer que eran más simples que todo eso, por lo menos inicialmente. Por otro lado, es improbable que Urbilateria fuera un cíclope con un solo ojo: lo menos que cabe esperar del inventor de la simetría bilateral es, bueno, que fuera simétrico bilateralmente y tuviera un ojo a cada lado, si acaso dos o tres ojos a cada lado, pero no uno solo en todo el centro. Pregunta para la ortodoxia darwiniana: ¿Por qué las anémonas, las medusas, las hidras o cualquier otro metazoo diploblástico no desarrollaron nunca, y siguen sin desarrollar, un ojo que merezca tal nombre? Al fin y al cabo tienen células complejas, pigmentos fotosensibles y todos los demás elementos necesarios para ascender por la escalera gradualista y adaptativa que expusimos al principio de este capítulo. La respuesta debe ser que hubo importantes fenómenos no adaptativos, no explicables por la selección natural, que debieron preceder necesariamente a la evolución del ojo en Urbilateria. La hipótesis más simple, como en el caso de la fila Hox, es que esos fenómenos estuvieran menos relacionados con la selección natural que con la dinámica interna del genoma, aunque en este caso no dispongamos aún de un modelo convincente.
¿Tenía patas Urbilateria? Quizá no tanto como patas, pero podemos estar razonablemente seguros de que tenía algún tipo de apéndices, porque el sistema genético complejo (basado en los genes Distaless, extradenticles, Meis y muchos otros) conforma hasta cierto punto una operación abstracta, es cierto, pero también es cierto que esa operación está especializada en señalar con el dedo a un grupo de células y destinarlas a formar un eje perpendicular al cuerpo del embrión. O sea, un apéndice. Es posible que Urbilateria sólo usara este sistema para fabricar un par de antenas, o una serie de jorobas a lo largo de su espalda, pero no hay ninguna razón que nos impida conjeturar que lo utilizó para construir una serie de patas más o menos simples.
Volvamos un minuto a la fila Hox. Argumentamos en el capítulo 7 que Urbilateria no sólo disponía de una fila Hox funcional equipada con sus baterías de genes downstream, sino que ya la utilizaba en la vida real —en la vida fenotípica, por así decir— para organizar las estructuras a lo largo del eje anteroposterior del cuerpo. La razón es que todos los animales bilaterales actuales la utilizan así, y resultaría extravagante adjudicar esa universalidad a la evolución convergente o a una coincidencia. Y, sin embargo, hay otro sentido en el que la fila Hox se puede considerar una operación más abstracta. Los vertebrados terrestres no sólo empleamos la fila Hox para organizar el eje anteroposterior del cuerpo, sino también para organizar otros ejes más tarde en el desarrollo del embrión, como el que distingue nuestros dedos en cada mano y cada pie. Como otros grupos animales no hacen nada parecido, debemos concluir que este uso secundario de la fila Hox es una invención que surgió durante la evolución de nuestros ancestros, mucho después de que Urbilateria campara por los fondos oceánicos precámbricos. Los vertebrados, por cierto, tenemos varias copias de la fila Hox completa, parecidas pero no idénticas. Nuestro linaje nunca ha renunciado al uso original de estos genes, pero sí los ha explotado más a fondo que los demás animales: los ha explotado también como una operación abstracta, útil para la organización de otros ejes distintos del anteroposterior. Es muy posible que ello explique muchos aspectos de la versatilidad evolutiva en la historia tardía de los vertebrados, sin excluir la vertiginosa evolución de nuestro asombroso cerebro humano, como veremos hacia el final del libro.
Hay más sistemas genéticos complejos que hicieron su primera aparición en Urbilateria y han permanecido esencialmente invariantes durante el resto de la historia del planeta, como el que organiza el eje dorsoventral de todos los embriones animales (sí, Urbilateria tenía también una espalda y un vientre), y sin duda el nuevo campo de la genómica comparada identificará pronto algunos más. Algunos reflejan la existencia de estructuras concretas en todos los animales, otros meras operaciones abstractas con las que la evolución posterior puede jugar a placer, y otros una mezcla de ambas cosas. Pero ninguno consiste en uno o dos genes sueltos que se pueden usar como ladrillos para construir cualquier tipo de casa: una y otra vez nos encontramos con habitaciones enteras y amuebladas, con sistemas genéticos complejos, compuestos por decenas o centenares de genes altamente integrados. La genética de los últimos 15 o 20 años ha revelado todo tipo de inesperadas tozudeces evolutivas, pero la gran sorpresa no es ya, como pensábamos en los años ochenta, que unos cuantos genes clave permanezcan constantes a lo largo de toda la historia animal: es que lo que permanece constante son sistemas genéticos complejos, completos y altamente integrados. Los acontecimientos más relevantes de la evolución animal, como el que separó a los vertebrados de los demás linajes, no parecen jugar libremente con unas cuantas mutaciones, a base de alterar en parsimoniosas gradaciones sus frecuencias relativas en la población. Al menos algunas de las principales innovaciones evolutivas no siguen la receta de Fisher y Dobzhansky: los que siguen esa receta son los darwinistas ortodoxos. Los linajes animales prefieren utilizar caminos evolutivos mucho más eficaces, basados en explorar nuevos usos de las operaciones complejas, completas y altamente integradas que, al menos en muchos casos, ya existían en Urbilateria. Ningún animal ha inventado un nuevo órgano partiendo de cero, por la fuerza bruta y paciente de la selección natural. La evolución, que es mucho más inteligente que los teóricos sintéticos de los años cuarenta, prefiere plagiar, duplicar, reutilizar y recombinar unidades funcionales mucho más complejas que el solitario gen egoísta de las ecuaciones ortodoxas. La clave de la evolución son los módulos. Echemos un vistazo a esta idea en el siguiente capítulo.